
Liên kết kim loại là gì? Phân biệt với liên kết ion và liên kết cộng hóa trị
Liên kết kim loại là gì? Kim loại có những kiểu mạng tinh thể nào phổ biến? Tính chất của tinh thể kim loại ra sao? Đây là những thắc mắc của nhiều đọc giả khi tìm hiểu về loại liên kết này. Chính vì thế, nội dung bài viết ngày hôm nay chúng ta sẽ giải đáp những thắc mắc này các bạn nhé!
I. Liên kết kim loại là gì?
Liên kết kim loại (tiếng anh là metallic bond) là một loại liên kết hóa học, được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể với sự tham gia của các electron tự do.
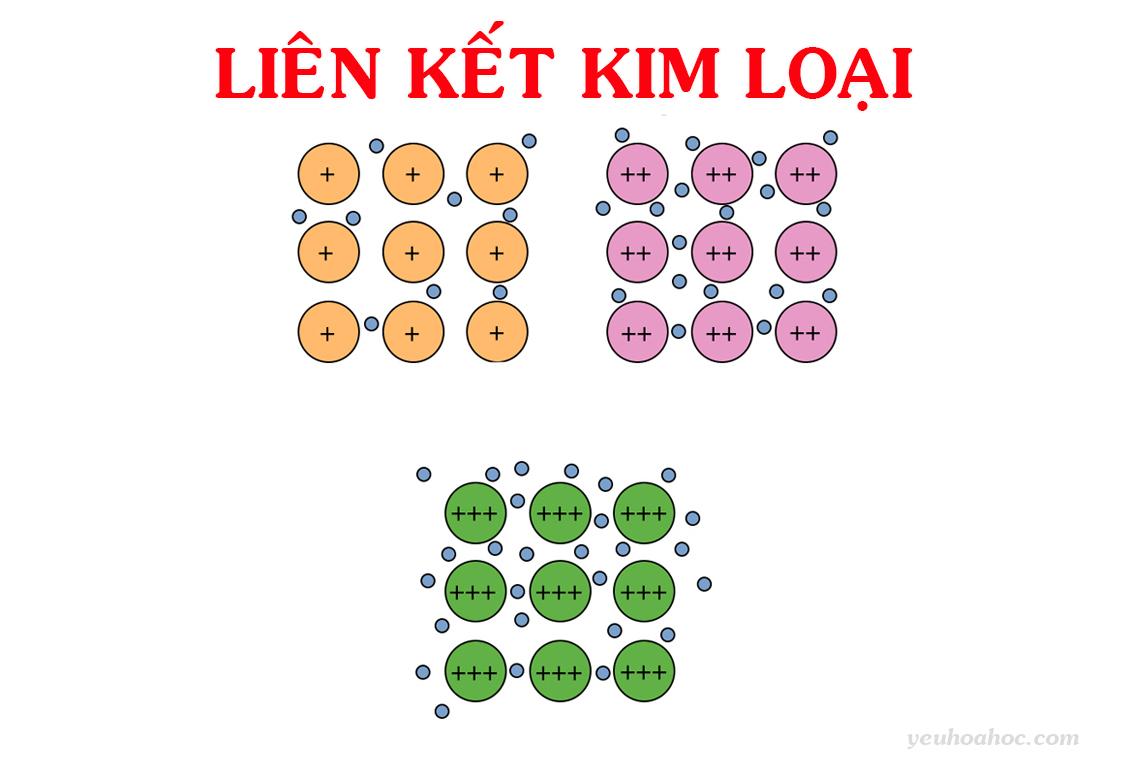
Ở điều kiện bình thường, hầu hết các kim loại tồn tại dưới dạng tinh thể (trừ thủy ngân). Trong những tinh thể này, các ion dương (+) và nguyên tử kim loại nằm ở các nút mạng. Các electron hóa trị do liên kết yếu với hạt nhân nên dễ tách khỏi nguyên tử và di chuyển tự do. Lực hút giữa các ion (+) này và các electron (-) tự do tạo nên liên kết kim loại.
II. Mạng tinh thể kim loại
Như đã trình bày ở trên, các kim loại tồn tại dưới dạng mạng tinh thể. Các mạng tinh thể kim loại tồn tại dưới ba dạng phổ biến như sau: lập phương tâm khối, lập phương tâm diện và lục phương.
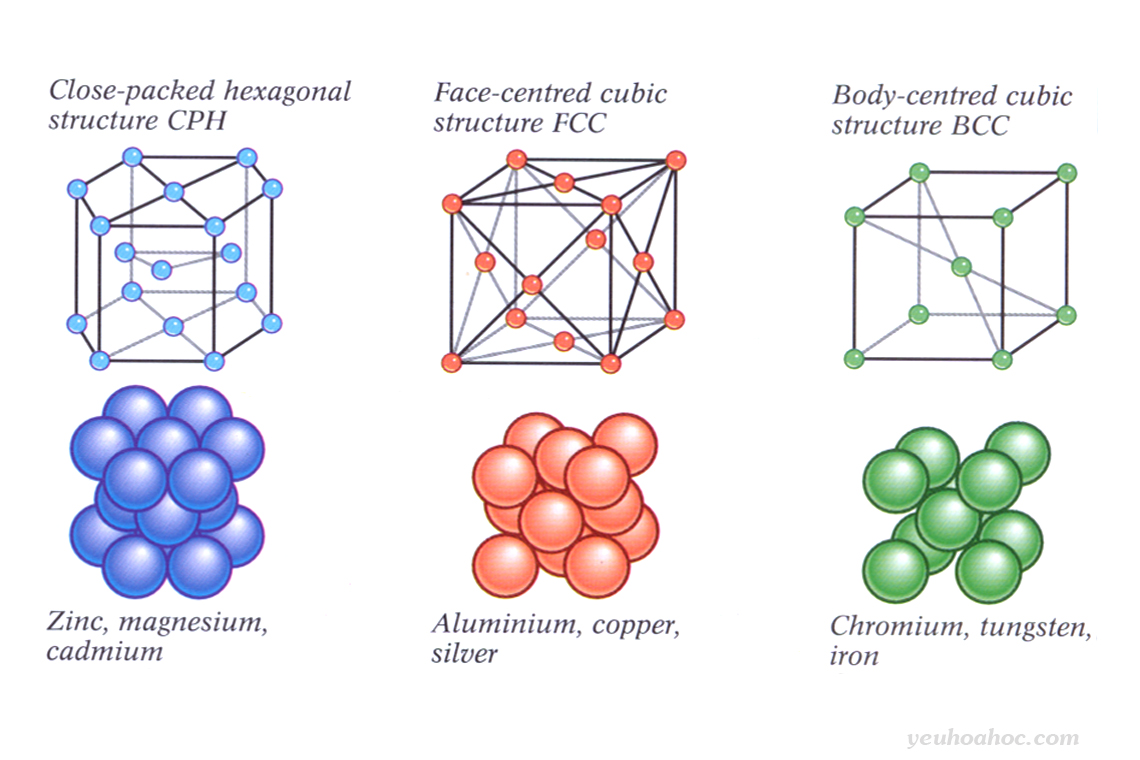
- Mạng tinh thể lập phương tâm khối: các nguyên tử, ion (+) kim loại nằm ở các đỉnh và tâm hình lập phương.
- Mạng tinh thể lập phương tâm diện: các nguyên tử, ion (+) kim loại nằm ở các đỉnh và tâm các mặt của hình lập phương.
- Mạng tinh thể lục phương: các nguyên tử, ion (+) kim loại nằm ở các đỉnh và tâm các mặt của hình lục giác đứng và 3 nguyên tử, ion nằm phía trong của hình lục giác.
III. Kiểu cấu trúc mạng tinh thể phổ biến của một số kim loại
Kiểu cấu trúc mạng tinh thể của một số kim loại trong bảng tuần hoàn các nguyên tố hóa học được thể hiện trong bảng dưới đây.
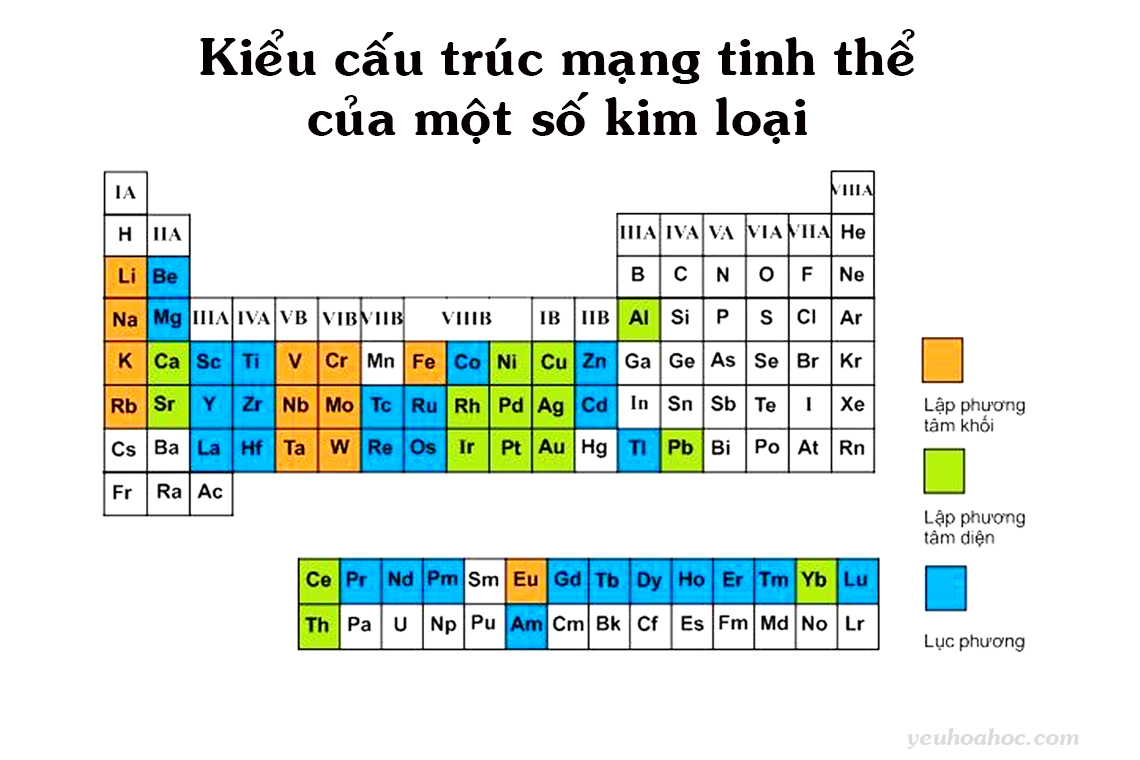
Ta có thể thấy:
- Một số kim loại có cấu trúc lập phương tâm khối như: kim loại kiềm Li, Na, K, Rb, Cr, Fe, W, Mo…
- Một số kim loại có cấu trúc lập phương tâm diện như: Ca, Sr, Ni, Cu, Ag, Au, Pd, Pt…
- Một số kim loại có cấu trúc lục phương như: Be, Mg, Ti, Zn, Tc, Re, Cd…
Để thể cho phần trăm thể tích mà các nguyên tử chiếm trong tinh thể đặc trưng cho từng loại cấu trúc ở trên, người ta dùng một đại lượng được gọi là độ đặc khít, kí hiệu là ρ. Phần trăm còn lại trong tinh thể là không gian trống. Theo đó:
- Cấu trúc lập phương tâm khối: ρ = 68%
- Cấu trúc lập phương tâm diện: p = 74%
- Cấu trúc lục phương: ρ = 74%
IV. Tính chất của tinh thể kim loại
Trong tinh thể kim loại có những electron tự do di chuyển được trong hệ thống mạng tinh thể. Chính liên kết kim loại như thế này đặc trưng cho nhiều tính chất vật lý của kim loại như độ dẫn điện, dẫn nhiệt, độ dẻo, độ bền, điện trở nhiệt, ánh kim, tính dễ kéo dài, dễ dát mỏng…
Một số tính chất khác như độ cứng, nhiệt độ nóng chảy, nhiệt độ sôi… phụ thuộc vào mật độ electron trong bán kính nguyên tử kim loại.
V. So sánh liên kết liên kết kim loại với liên kết ion và liên kết cộng hóa trị
- Liên kết kim loai giống với liên kết cộng hóa trị ở chỗ có sự dùng chunge lectron giữa các nguyên tử. Tuy nhiên, electrong trong lk kim loại là dùng chung của tất cả các nguyên tử có mặt trong đơn chất.
- Liên kết kim loại giống với liên kết ion ở chỗ đều được hình thành do lực hút tính điện của các phần tử tích điện trái dấu. Tuy nhiên, trong lk kim loại thì những phần tử này là ion (+) kim loại và các electron tự do.
Lời kết
Vậy là chúng ta vừa giải đáp được các thắc mắc được nêu ở đầu bài. Thực ra bản chất của liên kết kim loại không khó. Khi chúng ta nắm được thì có thể dễ dàng hiểu rõ bản chất của nó. Chúng ta cũng giải thích được cấu trúc mạng tinh thể của các kim loại. Hi vọng các bạn đã tìm được những thông tin bổ ích qua bài viết này. Còn nhiều bài viết khác ở nhiều chuyên mục khác trên website yeuhoahoc, mời các bạn tìm đọc. Cảm ơn và hẹn gặp lại các bạn ở những bài viết tiếp theo.
Link nội dung: https://uws.edu.vn/lien-ket-kim-loai-a42070.html