
Iod là gì? Iod (I) hóa trị mấy? Tổng hợp đầy đủ kiến thức về I-ốt
Iod là gì? Iod (I) hóa trị mấy? Có rất nhiều em đã gửi thắc mắc về nguyên tố Iod trong bảng tuần hoàn hóa học. Bài viết này, Admin sẽ giúp các em trả lời, đồng thời có những kiến thức bổ ích nhất về nguyên tố I-ốt này. Bắt đầu bài viết để tăng cường hiểu biết của bản thân các em nhé!
Iod là gì?
Iod hay Iodine là một nguyên tố hóa học với tên gọi bắt nguồn từ tiếng Hy Lạp là Iodes có nghĩa là “Tím”. Trong tiếng Việt, chúng ta vẫn thường gọi nguyên tố này là I-ốt với ký hiệu hóa học là I. Trong bảng tuần hoàn hóa học, Iodine có số hiệu nguyên tử là 53, thuộc nhóm VIIA, chu kỳ 5 với khối lượng nguyên tử lag 126,9 đvC.
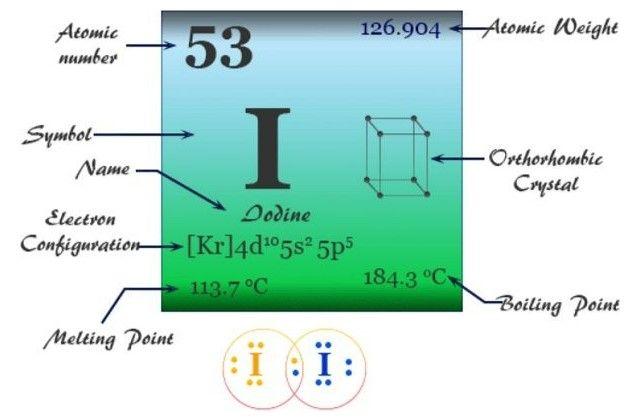
Iodine là gì?
Iodine (I) là một nguyên tố vi lượng rất cần thiết với sự sống của nhiều loài sinh vật khác nhau. Về mặt hóa học, nguyên tố này hoạt động ít trong nhóm các nguyên tố Halogen. Nó có độ âm điện thấp khoảng 2.66 theo thang đo Pauling.
Iodine được sử dụng rộng rãi trong các ứng dụng y tế, bao gồm điều trị các rối loạn tuyến giáp và là thành phần chính của các chất tẩy khử và chất diệt khuẩn. Ngoài ra, Iodine (I) cũng được sử dụng trong công nghiệp hóa chất, sản xuất chất tẩy, phân bón và các hợp chất hữu cơ.
Iod (I) hóa trị mấy?
Với số hiệu nguyên tử là 53, nguyên tố Iodine có cấu hình electron đầy đủ là: 1s22s22p63s23p63d104s24p64d105s25p5. Vì lớp ngoài cùng có 5e nên Iod thường có xu hướng nhận thêm 1e trong hợp chất, do đó Iodine (I) có số oxi hoá phổ biến nhất là -1. Tuy nhiên, Iodine cũng có thể có các số oxi hoá khác như +1, +3, +5 và +7 trong một số hợp chất của nó.

Cấu hình e của Iodine
I-ốt có mấy đồng vị?
Iodine là nguyên tố có đến 37 đồng vị, trong đó:
- Chỉ có đồng vị I 127 là bền
- Đồng vị I 131 là đồng vị phóng xạ và nó phát ra hạt Beta với chu kỳ bán phân rã là 8,0207 ngày. I 131 được đưa vào ứng dụng trong điều trị ung thư và các bệnh có liên quan đến tuyến giáp ở người.
- Còn đồng vị I 123 cũng là đồng vị phóng xạ, nhưng nó được đưa vào ứng dụng trong chụp ảnh tuyến giáp và đánh giá trị liệu đối với bệnh Grave.
- Đồng vị I 129 có chú kỳ bán phân rã là 15,7 triệu năm và nó có khả năng bắn phá hạt nhân X 129e bởi tia vũ trụ khi đi vào khí quyển Trái Đất.
Việc xử lý nhiên liệu hạt nhân và thử nghiệm vũ khí hạt nhân đã tạo ra lượng lớn I 129 vượt trội so với tự nhiên. Đồng vị I 129 được sử dụng trong nghiên cứu mưa sau vụ tai nạn Chernobyl và cũng có thể được sử dụng để phát hiện dấu vết chất thải hạt nhân trong mạch nước ngầm. Tiếp xúc với 129I có thể gây nguy cơ ung thư tuyến giáp, và người sống gần các khu vực phản ứng phân hạch thường được khuyến cáo sử dụng viên Iodine (I) để ngăn ngừa hấp thụ I 129.
I 129 có tính chất tương tự với C 36l, là một halogen hòa tan, ít hoạt động hóa học và tồn tại dưới dạng ion không hấp thụ. Mật độ I 129 được đo bằng tỷ lệ 129I so với tổng Iodine, và nó tồn tại trong tự nhiên ở mức rất thấp. Đồng vị I 129 có chu kỳ bán rã dài hơn và có sự hiện diện trong sinh vật dưới dạng ion với nhiều hành vi hóa học khác nhau. Nó dễ dàng nhập vào sinh quyển và có thể được tìm thấy trong cây cỏ, đất, sữa và mô sinh học.
Lịch sử phát hiện và nghiên cứu về nguyên tố Iod
Iodine được khám phá bởi Bernard Courtois vào năm 1811. Courtois là con trai của một nhà sản xuất Kali Nitrat, một chất được sử dụng trong thuốc súng. Trong quá trình sản xuất Kali Nitrat từ rong biển, Courtois phát hiện ra một chất khí màu tím. Ông nhận thấy chất khí này kết tinh thành tinh thể màu sẫm trên các bề mặt lạnh. Courtois đã chia sẻ mẫu tinh thể này với các nhà khoa học khác để tiếp tục nghiên cứu.

Lịch sử phát hiện và nghiên cứu về nguyên tố Iodine
Charles Bernard Desormes và Nicolas Clément tiếp tục nghiên cứu với mẫu tinh thể của Courtois. Họ thông báo về phát hiện này vào ngày 29 tháng 11 năm 1813. Joseph Louis Gay-Lussac và André-Marie Ampère cũng được thông báo và tham gia nghiên cứu. Gay-Lussac đã đề xuất rằng mẫu vật có thể là một nguyên tố hóa học mới hoặc một hợp chất oxygen. Ampère đã đưa mẫu vật cho Humphry Davy, người tiến hành thí nghiệm và nhận ra sự tương tự của Iodine với Chlorine.
Humphry Davy đã gửi thông điệp cho Hội Hoàng gia Luân Đôn vào ngày 10 tháng 12 để thông báo về việc phát hiện nguyên tố mới này. Một cuộc tranh cãi đã nổi lên về việc ai đã tìm ra Iodine trước tiên, nhưng cuối cùng Davy và Gay-Lussac đồng ý rằng Bernard Courtois là người đầu tiên đã phân lập nguyên tố Iodine này.
Trạng thái tự nhiên của Iod (I)
So với các halogen khác, Iodine có tồn tại rất ít trong vỏ trái đất. Điều này là do Iodine thường bị hòa tan trong nước biển và không tạo thành khoáng chất phổ biến như các nguyên tố khác.

Trạng thái tự nhiên của Iodine(I)
- Nước biển: Trong tự nhiên, Iodine được tìm thấy ở dạng hợp chất, chủ yếu là các muối Sodium và Potassium của nó. Nước biển là một nguồn chính của Iodine, và nồng độ Iodine trong nước biển có thể dao động tùy thuộc vào khu vực địa lý.
- Rong biển: Một số loài rong biển có khả năng hấp thụ Iodine từ môi trường xung quanh. Do đó, Iodine cũng có thể được tìm thấy trong một số hợp chất của rong biển.
- Tuyến giáp: Một sự xuất hiện đáng chú ý của Iodine là trong tuyến giáp của con người. Tuy Iodine chỉ có mức độ rất nhỏ trong tuyến giáp, nhưng nó lại rất quan trọng. Thiếu Iodine có thể gây ra bệnh bướu cổ, một tình trạng mà tuyến giáp phát triển quá mức để cố gắng bù đắp sự thiếu hụt Iodine.
Các tính chất vật lý của I-ốt
Các tính chất vật lý của Iodine là gì? Nó có các tính chất cơ bản như sau:

Các tính chất vật lý của Iodine
- Trạng thái vật chất: Iodine là một nguyên tố hóa học tồn tại dưới dạng chất rắn
- Màu sắc: Iodine có màu tím đen khi ở dạng chất rắn
- Điểm nóng chảy: Điểm nóng chảy của Iodine là khoảng 113,70C (236,70F). Ở nhiệt độ này, chất rắn Iodine chuyển sang trạng thái lỏng.
- Điểm sôi: Điểm sôi của Iodine là khoảng 184,30C (363,70F). Ở nhiệt độ này, chất lỏng Iodine chuyển sang trạng thái hơi.
- Khối lượng riêng: Khối lượng của Iodine là khoảng 4,93g/cm3. Điều này có nghĩa là một khối lượng nhất định của Iodine sẽ có thể chiếm một thể tích nhất định trong không gian.
- Hiện tượng thăng hoa: Khi đun nóng ở nhiệt độ cao, Iodine không nóng chảy và chuyển thành hơi màu tím. Khi làm lạnh thì hơi Iodine lại chuyển sang dạng tinh thể mà không chuyển qua trạng thái lỏng.
- Khả năng hòa tan: Iodine ít hòa tan trong nước, nhưng nó lại tan rất nhiều trong các dung môi hữu cơ như: Benzene, xăng, rượu,...
Các tính chất hóa học của Iod là gì?
Iodine (I) là một chất có tính oxi hóa mạnh, nhưng so với Chlorine hay Bromine thì tính oxi hóa kém hơn. Iodine có khả năng phản ứng với các kim loại, khí hydrogen, có tính oxi hóa và tính khử. Chi tiết như sau:

Các tính chất hóa học của Iodine là gì?
Tác dụng với kim loại
Khi cho Iodine (I) tác dụng với kim loại nó sẽ oxi hóa nhiều kim loại ở điều kiện nhiệt độ cao hoặc có chất xúc tác tham gia phản ứng.
2Al+3I2→2AlI3
Tác dụng với khí Hidro
Iodine hầu như không có tác dụng với nước, nhưng nó có thể oxi hóa khí Hydrogen ở điều kiện nhiệt độ cao và có chất xúc tác. Phản ứng hóa học sinh ra khí Hydro iodide không bền. Đây là một phản ứng hóa học thuận nghịch.
H2 +I2 ↔2HI
Hydro iodide lại là một chất có khả năng tan trong nước mạnh và nó tạo thành dung dịch Acid hydroiodic. Đây là một trong những acid mạnh, nó còn mạnh hơn cả acid HCl và HBr (HF < HCl < HBr < HI)
Tác dụng với Clo và Brom
Vì Iodine có tính oxi hóa yếu hơn Chlorine và Bromine, nếu trong phản ứng hóa học nó sẽ thế chỗ của Iodine trong hợp chất.
Cl2+2NaI→2NaCl+I2
Br2+2NaI→2NaBr+I2
Tính khử của axit HI
HI là một acid có tính khử mạnh, nó có thể khử được acid H2SO4 đặc. Phương trình hóa học xảy ra như sau:
8HI+H2SO4→4I2+H2S+4H2O
2HI+2FeCl3→FeCl2+I2+2HCl
Cách điều chế I-ốt
Iodine (I) được điều chế như thế nào? Trong công nghiệp, người ta thực hiện điều chế Iodine từ nguyên liệu rong biển. Ngoài ra, người ta còn thu Iodine tinh khiết bằng phương pháp cho KI tác dụng với Copper sulfate.

Cách điều chế Iodine
Cũng có một số cách khác để tác Iodine (I) ra khỏi hợp chất. Tảo bẹ cũng là một trong những loài thực vật có khả năng hấp thụ và tập trung khá nhiều Iodine trong cơ thể. Nó mang Iodine vào dây chuyền thức ăn tự nhiên và giúp cho việc điều chế Iodine (I) có giá thành thấp hơn rất nhiều.
Để thu Iodine (I) tinh khiết, người ta cho dung dịch Sodium iodide tác dụng với chất oxi hóa mạnh hơn, như Chlorine. Khi đó Chlorine sẽ đẩy Iodine khỏi hợp chất Sodium iodide để thế chỗ nó.
2NaI+Cl2→2NaCl+I2
Các ứng dụng của Iod (I) hiện nay
Chi tiết về các ứng dụng của Iodine (I) trong đời sống, sản xuất hiện nay như sau:

Các ứng dụng của Iodine (I) hiện nay
- Dinh dưỡng: Iodine là một nguyên tố vi lượng cần thiết cho sức khỏe con người. Thiếu Iodine có thể dẫn đến các tác hại như bệnh bướu cổ và thiểu năng trí tuệ. Sử dụng muối Iodine là một cách phòng ngừa hiệu quả cho tình trạng thiếu Iodine.
- Tuyến giáp: Iodine là thành phần cần thiết để tạo ra Hormone tuyến giáp, Thyroxine và triiodothyronine. Những Hormone này đóng vai trò quan trọng trong quá trình điều chỉnh chức năng của cơ thể.
- Khử trùng: Dung dịch Iodine được sử dụng làm thuốc bôi để khử trùng vết thương và bề mặt chứa nước uống trong tủ thuốc gia đình.
- Ứng dụng hóa hữu cơ và y khoa: Hợp chất Iodine có thể được sử dụng trong các ứng dụng hóa hữu cơ và y khoa như chất nhuộm, chất chống nhiễm khuẩn, và thuốc.
- Nhiếp ảnh: Muối Silver iodide (AgI) được sử dụng trong quá trình chụp ảnh để tạo ra hạt bạc phản ứng với ánh sáng và tạo nên hình ảnh.
- Điều trị phóng xạ: Muối Potassium iodide (KI) có thể được sử dụng để điều trị bệnh nhân bị ảnh hưởng của phản ứng phân hạch hạt nhân, như rửa trôi đồng vị phóng xạ I-131 và Cs-137.
- Công nghệ đèn: Vonfram Iodide được sử dụng để làm ổn định dây tóc của bóng đèn đèn tóc.
- Y khoa hạt nhân: Iodine-123 và Iodine-131 được sử dụng trong y khoa để tạo ảnh và xét nghiệm hoạt động của tuyến giáp và điều trị các bệnh liên quan đến tuyến giáp.
- Tính độc: Iodine nguyên chất có tính độc đối với tất cả các sinh vật.
Một số cảnh báo khi sử dụng Iod là gì?
Một số cảnh báo khi sử dụng Iodine (I) mà các em cần biết như sau:

Một số cảnh báo khi sử dụng Iodine là gì?
- Da tiếp xúc trực tiếp với Iod: Iodine có thể gây tổn thương cho da nếu tiếp xúc trực tiếp trong thời gian dài. Do đó, khi làm việc với Iodine, cần đảm bảo sử dụng thiết bị bảo hộ như găng tay, áo choàng và kính bảo hộ để tránh tiếp xúc trực tiếp với da.
- Mắt và màng nhầy tiếp xúc với Iodine: Hơi Iodine có thể gây khó chịu và kích thích mắt và màng nhầy. Nếu tiếp xúc với hơi Iodine, cần tiếp tục rửa mắt với nước sạch trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế nếu cần thiết.
- Mật độ Iodine trong không khí cao: Mật độ Iodine trong không khí nên được kiểm soát để đảm bảo an toàn. Trong một khoảng thời gian tiếp xúc kéo dài khoảng 8 giờ, mật độ Iodine trong không khí không nên vượt quá 1mm/m3, tính trung bình theo thời gian.
- Tuân thủ quy định an toàn: Khi làm việc với Iodine, cần tuân thủ các quy định và hướng dẫn an toàn được thiết lập bởi các tổ chức và cơ quan liên quan. Điều này bao gồm việc sử dụng thiết bị bảo hộ cá nhân, lưu trữ và vận chuyển Iodine theo quy định, và hạn chế tiếp xúc không cần thiết với nguyên tố này.
Như vậy, bài viết trên Admin đã tổng hợp và cung cấp mọi kiến thức quan trọng và có liên quan đến Iodine. Với chia sẻ trong bài, các em không chỉ biết Iodine là gì? Mà các em còn nắm rõ và hiểu đúng về Iodine. Một nguyên tố quan trọng với cả con người và các sinh vật sống. Nhưng khi sử dụng chúng ta cũng cần biết một số cảnh báo để lưu ý. Theo dõi Admin để đón đọc nhiều bài viết chia sẻ bổ ích hơn nữa về các nguyên tố hóa học trong bảng tuần hoàn nhé!
Link nội dung: https://uws.edu.vn/iot-hoa-tri-may-a34678.html