
Những phương pháp điều chế kim loại
1. Điều chế kim loại - Nguyên tắc cần nhớ
- Trong tự nhiên, hầu hết các kim loại đều tồn tại dưới dạng hợp chất trừ một số ít như vàng, platin... tồn tại dưới dạng tự do. Trong hợp chất đó, kim loại tồn tại dưới dạng ion dương. Vì vậy nguyên tắc điều chế kim loại là phải khử được ion kim loại thành dạng nguyên tử, hiểu đơn giản là phải tách các hợp chất chứa kim loại cần điều chế thành nguyên tử chứa kim loại độc lập.
- Phương trình phản ứng tổng quát trong điều chế kim loại: Mn+ + ne 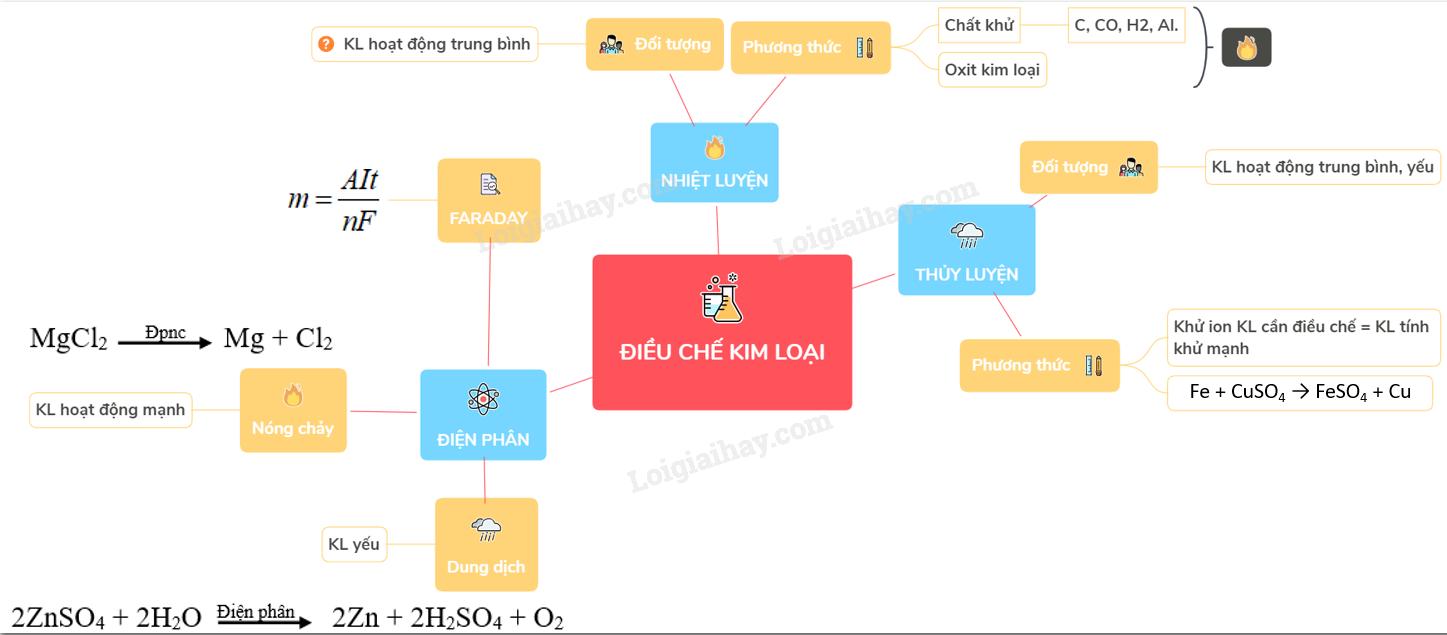 M
M
- Sơ đồ tư duy điều chế kim loại:

2. Điều chế kim loại - Các phương pháp
2.1 Phương pháp thủy luyện
- Phương pháp thủy luyện còn được gọi là phương pháp ướt, áp dụng điều chế các kim loại có mức độ hoạt động thấp như Cu, Hg, Au, Ag...
- Điều chế kim loại bằng phương pháp thủy luyện thường được sử dụng trong phòng thí nghiệm với mục đích điều chế những kim loại yếu đứng sau Mg.
- Cách điều chế: Sử dụng các dung dịch như HNO3, H2SO4, HCl, nước cường toan... để hòa tan hợp chất có chứa kim loại cần điều chế. Sau đó sử dụng một kim loại mạnh không tan được trong nước để đẩy kim loại yếu ra khỏi dung dịch thu được sau khi hòa tan.
Ví dụ 1: Điều chế kim loại Ag
- Nghiền nhỏ quặng bạc sunfua Ag2S rồi cho vào dung dịch NaCN. Sau khi lọc ta thu được dung dịch muối phức bạc. Sau đó, cho dung dịch muối phức bạc đó tác dụng với Zn để thu được Ag cần điều chế.
Ag2S + 4NaCN  2Na[Ag(CN)2] + Na2S
2Na[Ag(CN)2] + Na2S
Zn + 2Na[Ag(CN)2]  Na[Zn(CN)4] + 2Ag
Na[Zn(CN)4] + 2Ag
Ví dụ 2: Điều chế kim loại Au
- Hòa tan vàng lẫn trong đất đá bằng dung dịch NaCN trong không khí, ta thu được dung dịch muối phức vàng. Sau đó cho dung dịch thu được tác dụng với Zn để thu được Au
4Au + 8NaCN + O2 + H2O  4Na[Au(CN)2] + 4NaOH
4Na[Au(CN)2] + 4NaOH
Zn + 2Na[Au(CN)2]  Na2[ZNn(CN)4] + 2Au
Na2[ZNn(CN)4] + 2Au
- Lưu ý điều kiện để kim loại A đẩy được kim loại B ra khỏi dung dịch muối của nó:
+ A phải đứng trước B trong dãy điện hóa ( tức là A hoạt động mạnh hơn B)
+ Cả A và B đều không tan trong nước trong điều kiện thường.
+ Muối B tham gia và phản ứng và muối A tạo thành sau phản ứng đều phải là muối tan.
2.2 Phương pháp nhiệt luyện
- Đây là phương pháp được ứng dụng rộng rãi trong công nghiệp, áp dụng trong điều chế các kim loại có mức độ hoạt động trung bình như Pb, Fe, Zn, Cr, Sn...
- Cách điều chế: Sử dụng các chất khử mạnh như C, H2, CO, kim loại kiềm, kim loại kiềm thổ để khử ion kim loại trong hợp chất ở nhiệt độ cao.
Ví dụ 1: Điều chế Fe
Fe2O3 + 3H2 2Fe + 3H2O
Ví dụ 2: Điều chế Zn
ZnO + C Zn + CO
- Một số lưu ý khi điều chế kim loại bằng phương pháp nhiệt luyện:
+ Nếu sử dung kim loại kiềm, kiềm thổ làm chất khử thì phản ứng phải thực hiện trong môi trường chân không hoặc khí trơ.
+ Các loại muối kim loại sunfua như FeS2, ZnS, PbS... phải đưa về oxit kim loại tương ứng mới có thể điều chế được.
+ Những kim loại khó nóng chảy như Cr phải sử dụng Al làm chất khử để giảm chi phí nhiên liệu do phản ứng nhiệt nhôm sẽ tỏa nhiệt mãnh liệt, đủ để làm nóng chảy những kim loại kể trên.
+ Những kim loại hoạt động kém như Ag, Hg... chỉ cần đun chảy quặng là có thể thu được kim loại cần điều chế mà không cần sử dụng đến chất khử.
HgS + O2 Hg + SO2
Nhanh tay đặt bộ combo 12 cuốn sổ tay hack điểm khì thi tốt nghiệp THPT và kì thi đánh giá năng lực trước khi hết ưu đãi bạn nhé!
2.3 Phương pháp điện phân
a. Nguyên tắc chung
- Phương pháp điện phân là cách điều chế kim loại sử dụng dòng điện 1 chiều để khử ion kim loại thành ion tự do
- Phương pháp này có thể áp dụng điều chế hầu hết tất cả các kim loại.
- Phản ứng trong phương pháp điện phân các electron không trực tiếp cho nhau mà phải truyền qua dây dẫn do tác dụng của điện năng.
b. Điện phân nóng chảy
- Nguyên tắc: Dùng dòng điện 1 chiêu để khử ion kim loại trong chất điện li nóng chảy. Thường được sử dụng để điều chế các kim loại mạnh như Na, Mg, Ba, Ca, Al...
Ví dụ 1: Điều chế Al
- Điện phân nóng chảy dung dich Al2O3
+ Ở catot: Al3+ +3e  Al
Al
+ Ở anot: 2O2-  O2 + 4e
O2 + 4e
=> 2Al2O3 4Al + 3O2
Ví dụ 2: Sơ đồ điện phân nóng chảy NaCl để điều chế Na
c. Điện phân dung dịch
- Nguyên tắc: Sử dụng dòng điện 1 chiều để khử ion kim loại yếu trong dung dịch muối của nó, áp dụng trong điều chế các kim loại yếu
CuCl2 Cu + Cl2
- Nếu điện phân dung dịch có chứa các ion Mg2+, Ca2+, Al3+... thì H2O sẽ tham gia phản ứng.
2H2O +2e  H2 + 2OH-
H2 + 2OH-
d. Định luật Faraday
- Khối lượng của chất giải phóng ở mỗi điện cực tỷ lệ với điện lượng đi qua dung dịch và đương lượng của chát
Trong đó:
A: Khối lượng mol của nguyên tử chất thu được ở điện cực
n: Số e cho hoặc nhận.
I: Cường độ dòng điện ( A)
t: Thời gian điện phân (s)
F: Hằng số Faraday
Nhận ngay ưu đãi 50% bộ sách cán đích 9+ ba môn Toán Lý Hóa khi đăng kí ngay hôm nay nhé!
3. Bài tập vận dụng điều chế kim loại
Bài 1: Cần đủ 6,72 lít khí CO ở điều kiện tiêu chuẩn để khử hoàn toàn m gam Fe2O3. Tìm m.
Lời giải: Khi oxit bị khử bởi CO thì:
nO = nCO = 6,72 : 22,4 = 0,3 mol.
Áp dụng định luật bảo toàn nguyên tố:
3nFe2O3 = nO = 0,3 mol => nFe2O3 = 0,1 mol
=> m = 160.0,1 = 16g
Bài 2: Sử dụng 200ml hỗn hợp dung dịch gồm Cu(NO3)2 0,5M và AgNO3 0,3M phản ứng với 1,12g bột sắt. Phản ứng xảy ra hoàn toàn thu được m gam chất rắn A. Tính m.
Lời giải:
nFe = 0,02 mol ; nAgNO3 = 0,06 mol ; nCu(NO3)2 = 0,1 mol
ne Fe cho tối đa = ne Ag+ nhận tối đa = 0,02.3 = 0,06 mol
=> Fe phản ứng hết với Ag và tạo thành Fe3+ và Ag
=> nAg = nAgNO3 = 0,06 mol => m = 0,06.108 = 6,48g
Bài 3: Điện phân dung dịch CuSO4 với điện cực trơ, cường độ dòng điện 10A. Khi anot có 4 gam khí bay ra thì dừng lại. Hỏi khối lượng đồng thu được ở catot là bao nhiêu?
Lời giải:
nO2 = 0,125 mol
Catot: Cu2+ +2e Cu
Anot: 2H2O O2 + 4H+ + 4e
=> ne trao đổi = 4.nO2 = 0,5 mol
=> nCu = 0,5 : 2 = 0,25 mol => m = 16g.
>> Đăng ký ngay khóa học PAS THPT để được các thầy cô lên lộ trình học tập môn Hóa nhé!
Trên đây là những kiến thức về cách điều chế kim loại trong chương trình Hóa 12. Các em cần nắm rõ các phương pháp và nguyên tắc điều chế kim loại để giải đáp những câu hỏi bài tập, câu hỏi vận dụng lý thuyết trong đề thi trên lớp, đề thi tốt nghiệp THPT môn Hóa. Để biết thêm nhiều kiến thức Hóa học hữu ích, các em hãy truy cập trang web vuihoc.vn hằng ngày nhé!
>> Mời các em tham khảo thêm:
- Tìm hiểu chi tiết về sự ăn mòn kim loại
- Tổng hợp lý thuyết hợp kim và bài tập vận dụng
- Lý thuyết về kim loại kiềm
Link nội dung: https://uws.edu.vn/thuy-luyen-la-gi-a33057.html