Phản ứng Al + O2 → Al2O3
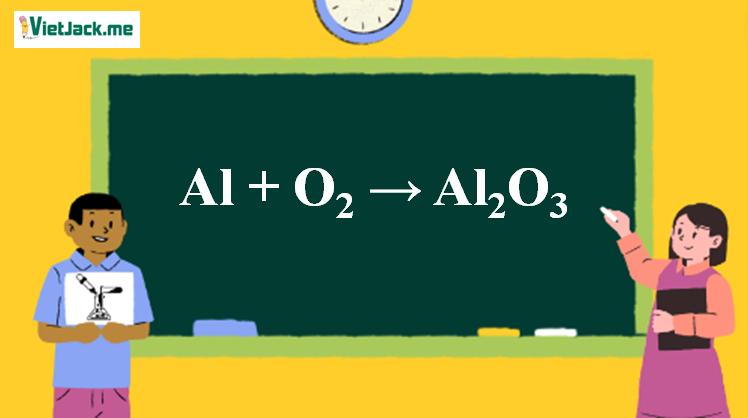
1. Phương trình phản ứng thí nghiệm Al ra Al2O3
2. Điều kiện thí nghiệm nhôm tác dụng với oxi
Nhiệt độ
3. Hiện tượng nhôm tác dụng với oxi
Hiện tượng: Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành màu trắng sáng là nhôm oxit Al2O3.
Giải thích: Vì ở điều kiện nhiệt độ này xảy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong phản ứng hóa học: nhôm đóng vai trò là chất khử.
4. Tính chất hóa học của nhôm
4.1. Tính chất vật lí của nhôm
- Nhôm là kim loại nhẹ (khối lượng riêng 2,7g/cm3).
- Màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm (660oC).
- Nhôm mềm, dễ kéo sợi và dễ dát mỏng.
- Nhôm dẫn điện và dẫn nhiệt tốt.
4.2. Nhận biết nhôm
Cho Al phản ứng với dung dịch NaOH (hoặc KOH). Hiện tượng quan sát được: Nhôm tan dần, sinh ra khí không màu.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
4.3. Tính chất hóa học của nhôm
- Tác dụng với oxi và một số phi kim.
4Al + 3O2→ 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
- Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội
- Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
- Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
- Tính chất hóa học riêng của nhôm.
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
- Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Cr2O3 + 2Al→ Al2O3 + 2Cr
4.4. Ứng dụng của Nhôm
Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt...
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
5. Tính chất hóa học của oxi
5.1. Tác dụng với phi kim
-
Với lưu huỳnh
+ Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi manh liệt hơn, tạo thành khí lưu huỳnh dioxit SO2 (còn gọi là khí sunfuro) và rất ít lưu huỳnh trioxit SO3
Phương trình hóa học:
S + O2 SO2
-
Với photpho:
+ Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong không khí. Bột trắng đó là điphotpho pentaoxit có CTHH là P2O5
Phương trình hóa học:
4P + 5O2 2P2O5
⇒ Vậy oxi có thể tác dụng với phi kim khi ở nhiệt độ cao. Trong hợp chất oxi hóa trị II
5.2. Tác dụng với kim loại
Cho dây sắt cuốn một mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hóa học là Fe3O4, thường được gọi là oxit sắt từ
Phương trình hóa học:
3Fe + 2O2 Fe3O4
5.3. Tác dụng với hợp chất
Khí metan (có trong khí bùn, ao, bioga) cháy trong không khí do tác dụng với oxi, tỏa nhiều nhiệt.
Phương trình hóa học:
CH4 + 2O2 CO2↑ + 2H2O
⇒ Oxi có thể tác dụng với kim loại, phi kim và các hợp chất ở nhiệt độ cao. Trong các hợp chất hóa học oxi hóa trị II.
6. Bài tập vận dụng liên quan
Câu 1. Cách nào sau đây không phá hủy các đồ dung bằng nhôm?
A. Dùng nước chanh để làm sạch bề mặt bằng nhôm
B. Rửa sach, lau khô và để chỗ khô ráo
C. Dùng đồ làm bằng nhôm để đựng nước vôi
D. Dùng đồ làm bằng nhôm để đựng nước biển
Lời giải:
Câu 2. Có 3 kim loại Al, Ca, Mg. Chỉ cần dùng thuốc thử nào sau đây có thể nhận ra từng kim loại?
A. dung dịch H2SO4
B. Dung dịch Ba(OH)2
C. Nước
D. dung dịch HCl
Lời giải:
Câu 3. Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 5,04 lít
Lời giải:
Câu 4. Quặng boxit là nguyên liệu chính dùng để điều chế kim loại
A. Al
B. Fe
C. Cu
D. Zn
Lời giải:
Câu 5. Các đồ vật làm bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Lời giải:


